Myopie-Management mit niedrig dosiertem Atropin in der klinischen Praxis
Zweck: Das Ziel der Studie war, die Therapiewirkung von niedrigdosiertem Atropin zum Zwecke der Hemmung der Myopieprogression im klinischen Alltag außerhalb von kontrollierten klinischen Studien zu bestimmen.
Material und Methoden: In einer retrospektiven Evaluation wurden für einen Beobachtungszeitraum von 12 Monaten die im klinischen Alltag erhobenen Daten (Refraktion, Achslänge) von 79 mit 0,01%Atropin behandelten myopen Kindern und 100 unbehandelt gebliebenen Kindern analysiert.
Ergebnisse: Beide Gruppen zeigten eine Myopieprogression mit insgesamt sehr variablen Progressionsraten. Eine zwei faktorielle Varianzanalyse für die Faktoren Alter und Atropinwirkung auf das Augenlängenwachstum zeigte einerseits ein abnehmendes Wachstum mit zunehmendem Alter (p < 0,0001) und eine vom Alter unabhängige hemmende Wirkung des Atropins auf das Längenwachstum (p < 0,0015). Dieser Effekt war jedoch mit nur 0,08 mm Wachstumshemmung pro Jahr (28 %) verglichen zur mittleren Augenlängenwachstumsrate der unbehandelten Kinder sehr gering.
Fazit: In dieser klinischen Umgebung ist die Atropinwirkung auf Refraktion und Augenlänge nicht sehr ausgeprägt und nur von geringer klinischer Relevanz. Unsere Analyse zeigt, dass unter den vorhandenen Voraussetzungen die vorteilhafte Wirkung von 0,01%Atropin auf Myopie nicht in jedem einzelnen Fall sichtbar werden muss, was Eltern und Hausaugenärzten kommuniziert werden sollte.
Purpose: The aim of the study was to determine the therapeutic effect of low-dose atropine for inhibiting myopia progression in clinical practice outside of controlled clinical trials.
Material and Methods: We performed a retrospective analysis on data collected on a regular basis (refraction, axial length) pertaining to 79 children treated with atropine and 100 untreated children over an observation period of 12 months.
Results: Our findings show that myopia progressed in both groups with highly variable progression rates. A two-way ANOVA for age and atropine effects on axial length growth revealed that axial length growth rates decline with age (p < 0.0001) and that atropine has a significant inhibitory effect on axial length growth (p < 0.0015) independent of age. However, this effect showed on average only a 0.08 mm inhibition rate per year (28 %) as compared to the growth rate in the untreated children, meaning that its magnitude is quite small. Furthermore, the effect of atropine on the refractive power was not significant.
Conclusion: We found that, in this clinical setting, the effects of atropine were not distinctive and of only minor clinical relevance. The results of this study show that the beneficial effects of a treatment with 0.01% atropine eye drops may not be apparent in every individual case, information that should be communicated to the parents of myopic children and general ophthalmologists.
Einleitung
Myopie entsteht durch ein Missverhältnis zwischen Brechkraft und Augenlänge des Auges.1 Dadurch liegt der Fernbrennpunk vor der Netzhaut im Glaskörper und auf der Netzhaut entsteht ein unscharfes Bild.1 Am häufigsten bei Kindern findet sich eine sogenannte Achsenmyopie (langer Bulbus), die auf ein übermäßiges Augenlängenwachstum zurückzuführen ist.2 Mit zunehmender Augenlänge erhöht sich die Myopie, und es steigt das Risiko für schwerwiegendere Erkrankungen im Alter, wie zum Beispiel Glaukom, Netzhautablösung und myopische Makuladegeneration, vor allem bei hohen Myopiegraden.3,4,5,6 Myopie beginnt meist schon in der Kindheit7, typischerweise mit Eintritt in die Grundschule. Die Progression setzt sich während des TeenagerAlters fort und kann bis ins junge Erwachsenenalter anhalten. Eine steigende Prävalenz der Myopie ist nicht nur in den sich weiter industrialisierenden ostasiatischen Ländern, sondern inzwischen auch in Europa zu beobachten.8
In den letzten Jahren wurden die Myopieprogression hemmende Strategien und Therapieoptionen entwickelt, darunter weiche oder formstabile multifokale Kontaktlinsen9,10, OrthokeratologieLinsen9,11, peripher defokussierende Brillengläser12,13 und Atropin.14,15 In randomisierten klinischen Studien unter streng kontrollierten Bedingungen konnte die Wirksamkeit von niedrig dosiertem Atropin bei vergleichsweise geringen Nebenwirkungen gezeigt werden.15-18 Die Wirksamkeit der Atropintherapie auf die Hemmung der Myopieprogression ist sehr dosisabhängig.15 Aber es steigen mit zunehmender Dosis auch die Nebenwirkungen.19
Von anderen ophthalmologischen TropfTherapien ist bekannt, dass die Therapieadhärenz, also das Maß in dem die Patienten die Therapie, wie mit dem Arzt vereinbart worden ist, durchführen, nicht optimal ist.20,21 Dadurch können diese Therapien nicht die gleiche Wirksamkeit wie sie in klinischen Studien gezeigt wurde, erreichen.
Ziel dieser Arbeit war es herauszufinden, wie wirksam niedrig dosiertes Atropin im klinischen Alltag außerhalb von kontrollierten klinischen Studien ist. Dazu haben wir die biometrischen Daten und die Refraktionsentwicklung von in unserer Praxis betreuten myopen Kindern retrospektiv analysiert.
Patienten und Methoden
Die Atropintherapie, die wir in den vergangenen 4 Jahren bei myopen Kindern durchgeführt haben, sah vor, dass an 5 Tagen der Woche abends vor dem Zubettgehen jeweils 1 Tropfen einer stark verdünnten Atropinlösung (0,01 %) in jedes Auge gegeben wird. Dieses Schema entspricht der Mindestvorgabe der LAMPStudie.15 Ein strengeres, damit auch belastenderes Tropfschema, wurde nicht verordnet, um die Therapietreue der jungen Patienten und ihren Eltern auch über einen langen Zeitraum zu erhalten. Kontrollvisiten sollten alle 6 Monate stattfinden; dabei wurden jeweils Refraktion und Achslänge der Augen neu bestimmt. Die biometrische Bestimmung der Augenlänge der Augen erfolgte mit dem IOLMaster 700 (Carl Zeiss Meditec, Jena, Deutschland). Die subjektive Refraktion wurde teilweise ohne Zykloplegie durchgeführt.
Es wurde aber immer dann zykloplegiert, wenn die Kinder in der Refraktion eine offensichtliche Tendenz zum Akkommodieren zeigten.
Bei einer Refraktionsänderung von mehr als 0,5 dpt und einem damit verbundenem Visusanstieg wurden neue Brillengläser empfohlen. Für die vorliegende 1-Jahres Analyse wurden Daten von 115 atropinbehandelten Kinder berücksichtigt, die mindestens eine Kontrollvisite wahrgenommen hatten.
Refraktion und auch Augenlänge werden in unserer Praxis routinemäßig auch bei denjenigen myopen Kindern bestimmt, die keine Atropinbehandlung oder sonstige myopiehemmende Intervention erhalten. 212 unbehandelte myope Kinder mit mindestens zwei Visiten dienten als Kontrollgruppe.
Da die tatsächlichen zeitlichen Intervalle zwischen den Visiten sehr unterschiedlich waren, wurden schließlich nur Daten derjenigen Kinder statistisch ausgewertet, bei denen eine Kontrollvisite in einem Zeitraum von 9 – 15 Monaten nach Beginn der Behandlung liegt. Dies war meist die zweite oder dritte Visite nach Behandlungsbeginn (1. Visite). Dieses Intervall von 9 – 15 Monaten wird im weiteren Verlauf „12Monatsintervall“ genannt. Die Wachstumsraten (Wachstum pro Jahr) wurden individuell aus dem tatsächlichen Zeitintervall zwischen diesen beiden Visiten auf einen 12Monatszeitraum normiert. Frühere oder spätere Kontrollvisiten derselben Kinder wurden in die statistische Analyse nicht eingeschlossen. Schließlich wurden 79 atropinbehandelte Kinder, bei denen Daten für eine Nachuntersuchung im Zeitraum von 12,7 ± 1,4 Monaten vorlagen, und 100 myope Kinder ohne Behandlung, bei denen eine Nachuntersuchung im Zeitraum von 12,5 ± 2,1 Monaten erfolgte, statistisch ausgewertet. Die statistische Analyse erfolgte als zweifaktorielle Varianzanalyse für die Faktoren: Alter der Kinder und Art der Behandlung (Atropinbehandlung/keine Atropinbehandlung).
Die analysierten Daten wurden in der klinischen Routine erhoben; es wurden keine Daten extra erhoben oder zusätzliche Maßnahmen durchgeführt.
Ergebnisse
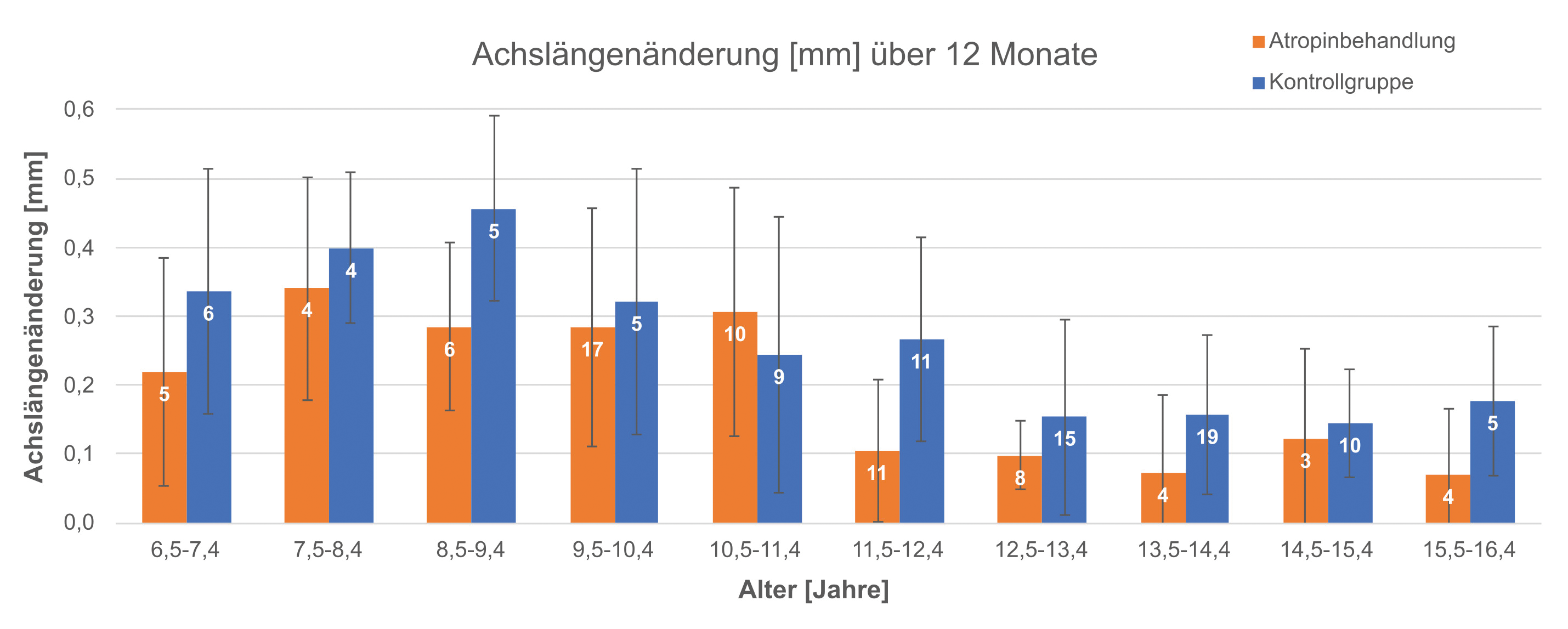
Die Patientencharakteristika sind in Tabelle 1 dargestellt. Insgesamt berichteten 16,7 % der Kinder von Nebenwirkungen; diese waren vor allem Augenbrennen nach dem Tropfen (9,7 %), erweiterte Pupillen noch am Tag nach dem abendlichen Tropfen (5,6 %), Blendempfindlichkeit (5,6 %) und Rötung der Augen (5,6 %). Ein Kind (< 1 %) berichtete über Probleme beim Lesen in kurzen Leseabständen (15 cm) und ein Kind hatte das Gefühl, häufiger und stärker blinzeln zu müssen. Eine klinisch signifikante Einschränkung der Akkommodationsfunktion durch die Atropinbehandlung konnte nicht festgestellt werden.
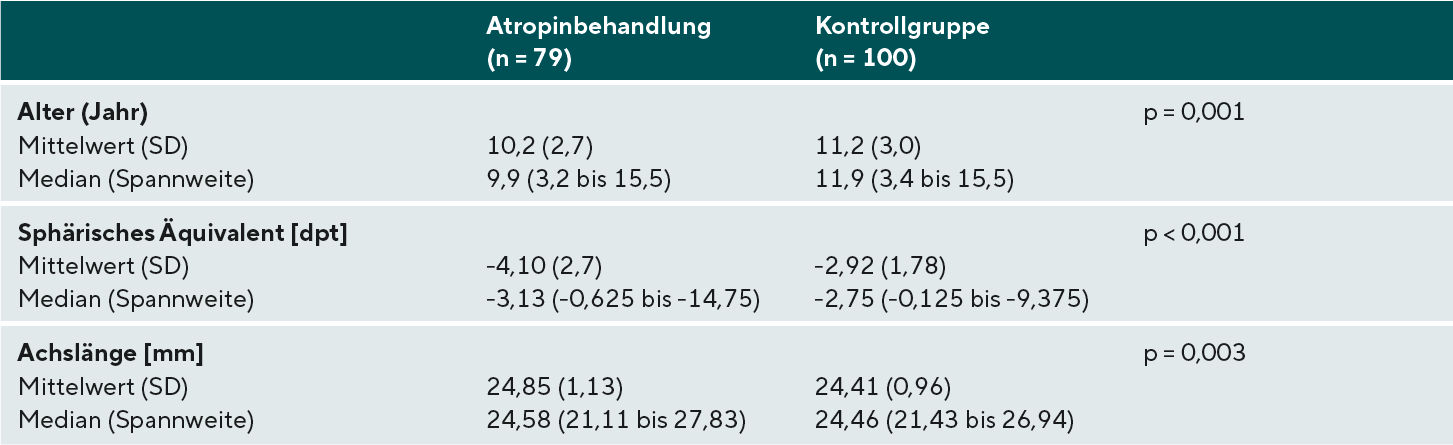
Um Effekte des niedrig dosierten Atropins auf die Myopieprogression zu evaluieren, sind in Bild 1 die Myopieprogressionsrate [dpt/Jahr] und die Augenlängenwachstumsrate [mm/Jahr] für jedes Auge dargestellt.
In Bild 2 wurden die Daten der Kinder (ab 6 Jahre) beider Gruppen nach dem Alter in 10 Altersklassen aufgeteilt, so dass das jährliche Achslängenwachstum jeweils nur bei Kindern desselben Lebensalters verglichen wurde. Die Anzahlen der Kinder unter 6 Jahre pro Gruppe waren zu gering für eine Aussage und sind daher grafisch nicht dargestellt und statistisch ausgewertet. In fast allen Altersklassen ist in der Kontrollgruppe eine stärkere Achslängenzunahme zu beobachten. Die zweifaktorielle Varianzanalyse zeigt, dass die jährliche Wachstumsrate mit zunehmendem Alter sinkt (p < 0,0001). Die Varianzanalyse zeigt außerdem eine vom Alter unabhängige Hemmung des Augenlängenwachstums durch die Atropinbehandlung (p < 0,0015). Werden für jede Altersklasse die Differenzen im Augenlängenwachstum der Atropinkinder und der unbehandelten myopen Kontrollgruppe berechnet, ergibt sich im Mittel eine Hemmung des Augenlängenwachstums von 0,08 mm (28 %) in der mit Atropin behandelten Gruppe gegenüber der unbehandelten myopen Kontrollgruppe. Wird die gleiche Auswertung auf die Refraktion (sphärisches Äquivalent) angewandt, zeigt sich, dass der Effekt des Atropins auf Refraktion nicht signifikant ist (p = 0,6).
Werden die Kinder nach Grad des Augenlängenwachstums gruppiert, zeigt sich: 51 % der Atropinkinder und 47 % der myopen Kinder der Kontrollgruppe zeigten leichte Progression von weniger als 0,5 dpt/Jahr; 26 % der Atropinkinder und 28 % der Kinder der Kontrollgruppe zeigten moderate Progression (von 0,5 bis 1,0 dpt/Jahr); 23 % der Atropinkinder und 25 % der myopen Kinder der zeigten schwere Progression (mehr als 1 dpt/Jahr).
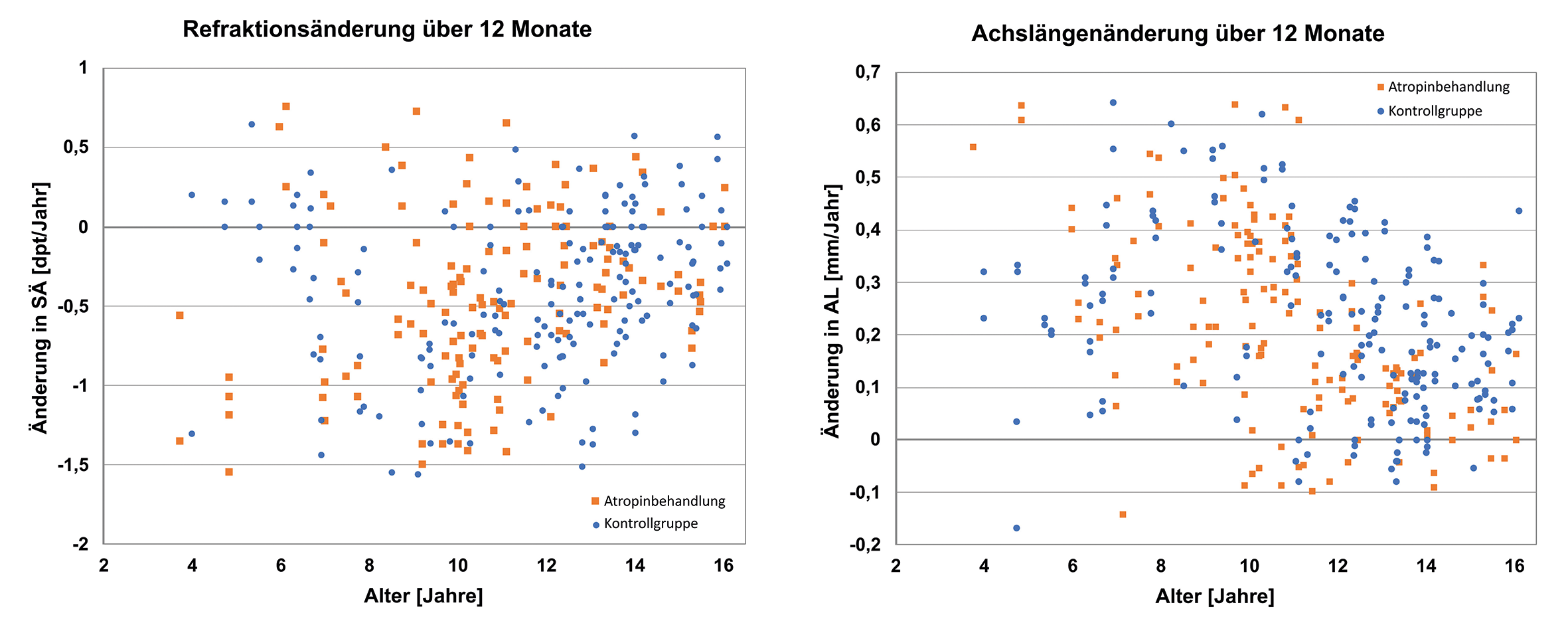
Diskussion
Die hier analysierten Daten entstammen keiner randomisierten und kontrollierten Studie, sondern der klinischen Routine und wurden wohl unter Bedingungen erhoben, unter denen Kinder in Deutschland eine Myopietherapie mit Atropin erhalten.
Der Effekt von niedrig dosiertem Atropin (0,01 %) auf die Myopieprogression in der klinischen Routine war im Durchschnitt nicht groß. Statistisch signifikante Effekte wurden nur dann sichtbar, wenn alle Patienten zusammen verglichen wurden. Die mit der Atropinbehandlung beabsichtigte hemmende Wirkung auf die Myopieprogression würde daher wohl nicht in jedem Einzelfall erkennbar werden; dies wurde ebenfalls aus der asiatischen LAMPStudie von Yam et al.14,15 berichtet.
Wir fanden eine Wachstumshemmung bei Atropinbehandlung, die nicht vom Alter der Kinder abhängig war. Li und Kollegen22 hingegen fanden, dass die Augen jüngerer Kinder weniger stark auf die Atropinbehandlung ansprachen.
Wir fanden außerdem lediglich einen Effekt auf die Achsenlänge, aber nicht auf die Refraktion. Das kann darauf zurückzuführen sein, dass die Refraktionsbestimmung nicht durchgängig unter Zykloplegie durchgeführt worden ist. Um den Effekt von Myopie-Therapien zu quantifizieren, schlugen Brennan et al.23 daher die „cumulative absolute reduction of axial elongation” vor. Die Achsenlänge ist der relevantere Wert zur Abschätzung des individuellen Risikos pathologischer Veränderungen aufgrund hoher Myopie, da diese Veränderungen unmittelbar mit dem zu lang gewachsenen Augapfel in Zusammenhang stehen.
Die Therapieadhärenz bei Tropf-Therapien, deren Durchführung der Eigenverantwortung unterliegen, kann gering und sehr variabel sein.20,21 In der hier vorliegenden retrospektiven Analyse wurde kein Kontrollinstrument eingesetzt, um die Adhärenz zu überprüfen. Es wurde zwar den Eltern erklärt, dass eine konsequente und regelmäßige Anwendung der Atropintropfen notwendig sei, um eine Hemmung der Myopieprogression zu erreichen. Stichprobenartige Überprüfungen zeigten allerdings, dass zum Teil bis zu 50 % weniger Atropin bestellt wurde, als rein rechnerisch hätten bestellt werden sollen.
In einer zusammenfassenden Darstellung sind in Bild 3 die gängigen Therapieoptionen nebeneinandergestellt. Dabei wurde wie in Bild 2 die durchschnittliche jährliche Achslängenänderung (Augenwachstumsrate) gegen das Alter der Kinder aufgetragen, und zwar so, wie es sich im Mittel 1 Jahr oder 2 Jahre nach Therapiebeginn mit der jeweiligen Therapieoption einstellt. Daneben sind auch die Wachstumsraten der Kontrollgruppen dieser Studien (in blauer Farbe) eingetragen; diese repräsentieren jeweils das myope (übermäßige) Augenwachstum der unbehandelten Kinder. Die durchgehende graue Linie zeigt das von uns aus den Arbeiten von Truckenbrod und Kollegen24 extrahierte Wachstum von Kindern, die im Erwachsenenalter weiterhin emmetrop sind (emmetropes Augenwachstum). In der klinischen Praxis des Myopiemanagements kann das emmetrope Augenwachstum als Zielgröße für die Therapieeffizienz herangezogen werden.

Die Daten der vorliegenden Studie (ungefüllte Rechtecke) wurden zum Vergleich (Bild 2) in zwei Altersgruppen aufgeteilt. Diese wurden so gewählt, dass die dem Alter der Kinder der LAMPStudie14,15 nach dem ersten Jahr der Atropinbehandlung entsprechen. Die in dem 12Monatsintervall gefundene atropininduzierte Wachstumshemmung entspricht in etwa dem, was in der asiatischen LAMPStudie erst bei einer höheren Atropindosis (0,025 %) erreicht wurde. 15 Betrachtet man jedoch das deutlich stärkere myope Wachstum der LAMPKontrollgruppe relativiert sich diese Aussage. Emmetropes Augenwachstum ist in der asiatischen Bevölkerung, wie SanzDiez et al.25 zeigen, wenig anzufinden. Dennoch unterscheidet sich das emmetrope Wachstum der Asiaten nach unseren Analysen kaum von dem emmetropen Augenwachstum deutscher Kinder (bearbeitet aus Truckenbrod et al.24).
Vergleichbare Ergebnisse finden sich für die Therapieoptionen der OrthokeratologieLinsen („OrthoK“) aus der ROMIOStudie von Cho et al.11 und der bifokalen Kontaktlinsen aus der BLINKStudie von Walline et al.10 Es ist aus in der in Bild 3 gewählten Darstellung zu erkennen, dass in diesen klinischen Studien die Therapieeffizienz der OrthokeratologieLinsen11 und der bifokalen Kontaktlinsen mit hoher Nahaddition10 in etwa der Therapieeffizienz der Maximaldosis von 0,05 % Atropin in der asiatischen LAMPStudie14,15 entsprechen. Bei dieser Dosis wäre nach neueren Untersuchungen von Joachimsen et al.26 jedenfalls bei deutschen Kindern die Toleranzschwelle für die langfristige Atropintherapie überschritten.
Bemerkenswert sind die 1 bis 3 Jahresergebnisse einer ersten klinischen Studie zu neuen peripher defokussierenden Brillengläsern (D.I.M.S.) von Lam et al.13 Sie zeigen nach jeweils einem, zwei und drei Jahren der Therapie eine vergleichsweise hohe Therapieeffizienz. Interessant ist dabei vor allem der direkte Vergleich der Ergebnisse der LAMPStudie14,15, da sich die Patienten aus derselben ethnischen Gruppe mit denselben soziokulturellen Bedingungen rekrutieren.
Fazit
- Unsere retrospektive Analyse zeigt, dass auch in einer nichtkontrollierten und randomisierten Studie, ein statistisch signifikanter, aber klinisch schwacher Effekt von nieder dosiertem Atropin auf Augenlängenwachstum beobachtet werden kann.
- Allerdings waren die Effekte unter den gegebenen Bedingungen nicht bei allen Patienten erkennbar, was den Eltern vermittelt werden sollte, um übersteigerte Erwartungen zu verhindern.
- Alternative Therapieoptionen können bei den Patienten gegebenenfalls eine stärkere Hemmung der Myopieprogression bewirken.
Interessenkonflikt
Die Autoren haben keinen Interessenkonflikt in Bezug auf die im Artikel genannten Methoden und Geräte.
