Telemedizin und künstliche Intelligenz im Zusammenhang mit Augenscreening
Aktueller Stand und Zukunftsaussichten für die Optometrie in DeutschlandZweck: Es wird evaluiert, ob telemedizinische Modelle oder Untersuchungs- und Präventionsmodelle, die auf künstlicher Intelligenz basieren, Optometristen in Deutschland die Möglichkeit bieten, ihren Status als Gesundheitsdienstleister für das Auge und visuelle System zu verbessern und eine effizientere Augenversorgung zu gewährleisten.
Material und Methoden: Zur Evaluierung wurde sowohl eine systematische Literaturrecherche als auch eine Befragung von Experten herangezogen. Es wird auf Studienergebnisse zu Deep-Learning-Anwendungen beim Augenscreening in den Bereichen Glaukom, altersbedingte Makuladegeneration und diabetische Retinopathie sowie auf die Ergebnisse der Expertenbefragung eingegangen.
Ergebnisse: Die Studienergebnisse und Expertenbefragungen zeigen, dass eine Zusammenarbeit zwischen Optometristen und Augenärzten in einem telemedizinischen Netzwerk für eine bessere Augenversorgung der Bevölkerung und die Entlastung der Augenärzte bei Routineaufgaben unerlässlich ist. Das erste telemedizinische kooperative Gesundheitsprogramm in Deutschland zwischen Optometristen und Augenärzten zeichnet sich durch eine erfolgreiche Zusammenarbeit aus.
Fazit: Künstliche Intelligenz (KI) findet immer mehr Anwendung im Bereich Augenscreening. Telemedizin und die elektronische Patientenakte (EPA) spielen dabei eine spezifische Rolle. Dadurch können Optometristen in Deutschland ein hochqualitatives Dienstleistungsangebot in ihrem Fachbereich gewährleisten und ausbauen.
Purpose: This paper aims to evaluate whether telemedical models or examination and prevention models based on artificial intelligence offer German optometrists a chance to increase their status as vision care providers and to provide better eye care in Germany.
Material and Methods:
Both a systematic literature review and an expert survey were conducted. Study results of deep learning vision screening applications in the fields of glaucoma, age-related macular degeneration, and diabetic retinopathy as well results of expert interviews are discussed.
Results: The study results and expert interviews demonstrate that cooperation between optometrists and ophthalmologists in a telemedical network is an essential tool for improving the eye health care of the population and relieves ophthalmologists of routine tasks. The first telemedical cooperative program between German optometrists and ophthalmologists demonstrates a successful cooperation.
Conclusion: Artificial intelligence (AI) is increasingly finding its way into the field of vision screening. Telemedicine and the electronic patient medical record play a unique role. They enable German optometrists to secure and expand high-quality service offerings in the field of optometry.
Einleitung
Angesichts der weltweiten Zunahme von Augenerkrankungen, die zu Erblindung führen können, stellt sich die Frage, wie eine optimale Gesundheitsversorgung erreicht werden kann. Diese Entwicklung ist teilweise zurückzuführen auf den demografischen Wandel und die Alterung der Bevölkerung in den Industriestaaten sowie die rasche Änderung der geografischen Gesundheitsversorgungsstrukturen (Abwanderung aus den Städten aufs Land). Es werden jedoch schon sehr schnell technische Lösungen entwickelt wie eine höhere Genauigkeit von Diagnosegeräten, deren Ergebnisse mithilfe von künstlicher Intelligenz ausgewertet werden. Mit einigen KI-Verfahren erzielt man eine Diagnosegenauigkeit, die jene von Augenärzten und ophthalmologischem Fachpersonal übertrifft.
Welche Rolle kann Technologie in Form von Telemedizin und künstlicher Intelligenz bei der Verbesserung der Augenversorgung und des Augenscreenings durch Optometristen in Deutschland spielen? In diesem Artikel werden die wichtigsten derzeit eingesetzten technischen Systeme beschrieben, wobei der Schwerpunkt besonders auf jene gelegt wird, die Optometristen in Deutschland zur Verfügung stehen. Mithilfe dieser Systeme könnten Optometristen nicht nur mehr zur Präventivvorsorge im Bereich Augengesundheit beitragen, sondern auch eine weitere Schnittstelle im praktischen Aus-und Weiterbildungssystem für Optometristen darstellen. Telemedizin könnte ein guter Weg sein, durch diese Schnittstellen eine engere Zusammenarbeit zwischen Optometristen und Augenärzten zu ermöglichen; dies würde den Patienten zugutekommen, weil in Deutschland in Regionen mit ineffizienten Gesundheitsversorgungsstrukturen ohnehin schon ein struktureller Ärztemangel herrscht und Patienten lange Anfahrtswege zur nächsten Arztpraxis in Kauf nehmen müssen.1 Gleichzeitig könnte mithilfe dieser KI-Systeme die klinische Qualifikation von Optometristen in Deutschland erheblich verbessert werden.
Material und Methoden
Der Stand der Wissenschaft und Technik wird in diesem Artikel anhand von zwei verschiedenen Ansätzen ermittelt: Recherche in wissenschaftlichen Datenbanken und qualitative Interviews mit Marktanbietern von Telegesundheitsleistungen für Augenscreenings in Deutschland sowie mit Marktanbietern, die künstliche Intelligenz zur Unterstützung von Optometristen einsetzen.
Augenscreening durch Optometristen in Deutschland
In Deutschland sind Optometristen im Gesundheitssektor angesiedelt; es gibt keine gesetzlichen Einschränkungen, was die Verwendung von Untersuchungsgeräten anlangt. Der Einsatz von Arzneimitteln zu diagnostischen und therapeutischen Zwecken ist Optometristen jedoch nicht erlaubt. Optometristen in Deutschland dürfen bei Auffälligkeiten am Auges eine Verdachtsdiagnose stellen.2 Sie führen sowohl Screening-verfahren zur Erkennung von Anomalien des Auges als auch umfassende Augenuntersuchungen durch. In den klinischen Leitlinien des Zentralverbandes der Augenoptiker und Optometristen in Deutschland werden die Unterschiede zwischen Screeningverfahren und einer umfassenden optometrischen Augenuntersuchung erläutert.3 Da es in Deutschland keine einheitliche Ausbildung für Augenoptiker und Optometristen gibt, bestehen weniger Möglichkeiten, diese Berufsgruppe stärker in den Bereich der augenspezifischen Gesundheitsversorgung einzubeziehen.
Internationalisierung der Hochschulausbildung in Deutschland
Die Bachelor- und Master-Studiengänge in Deutschland entsprechen der internationalen Ausbildung zum Optometristen im Sinne eines primary eye care provider, nachdem klinisch-optometrische Ausbildungsinhalte in deren Curricula aufgenommen wurden. Das in der internationalen Hochschulausbildung übliche klinisch-optometrische Praktikum, das unter Aufsicht eines Optometristen mit anschließender eigenständiger Prüfung durch den Berufsverband erfolgt, ist jedoch in Deutschland noch nicht eingeführt worden.4
Telemedizin
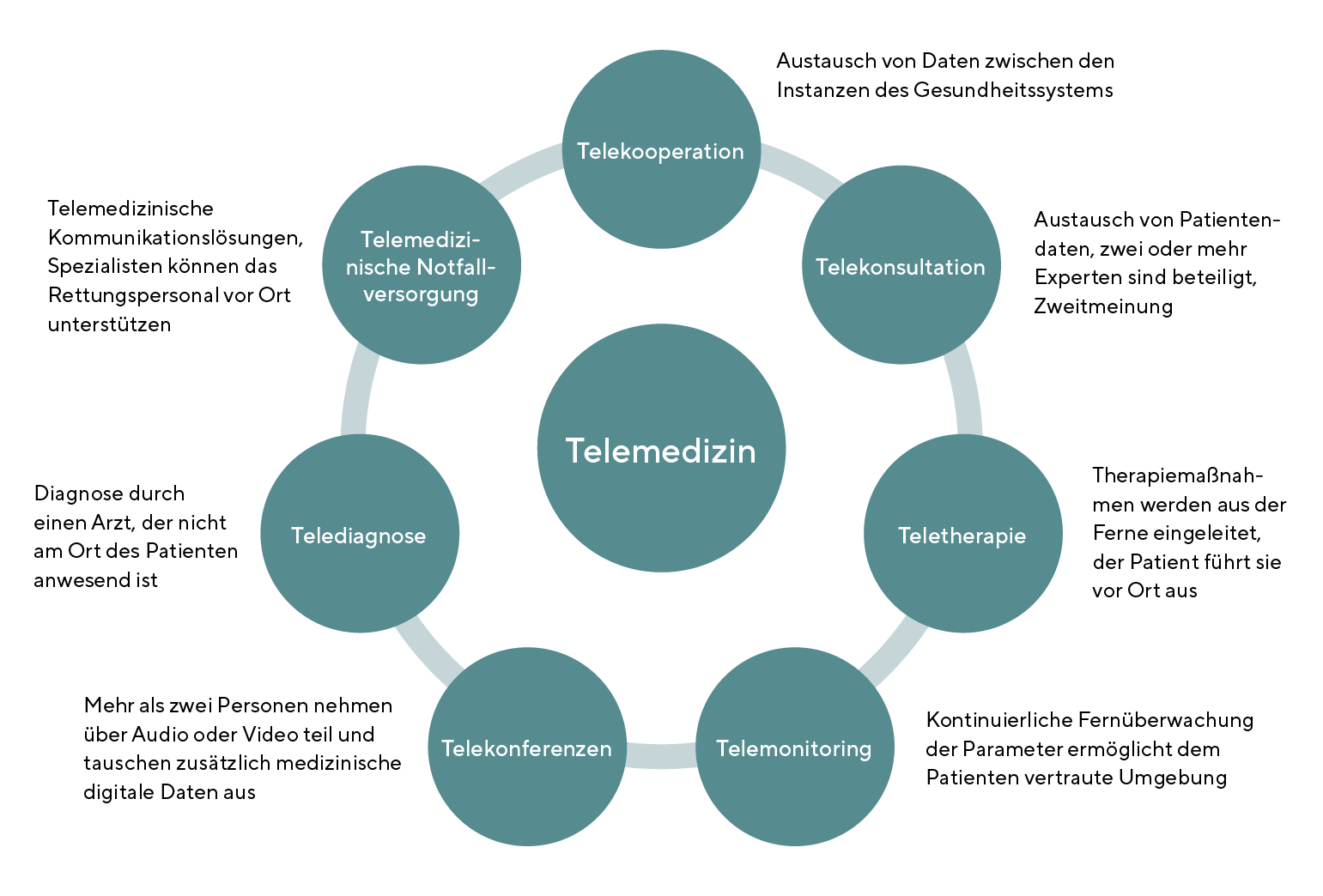
Unter Telemedizin versteht man die Anwendung von Kommunikations- und Informationstechnologien im Rahmen der Gesundheitsversorgung, wobei sich Gesundheitsdienstanbieter und Patienten nicht am selben Ort befinden.3 Telemedizin wird auch als E-Health und Gesundheits-telematik bezeichnet. Die Besonderheiten dieser neuen digitalen Technologien resultieren nicht nur aus dieser räumlichen Distanz, sondern auch aus der Möglichkeit, die zeitliche Komponente variieren zu können. Der Kontakt kann synchron (Echtzeitsysteme) oder asynchron um Stunden oder Tage zeitversetzt (Store-and-Forward-Systeme, SAF) erfolgen. Telemedizin ist konzipiert für den Einsatz in der medizinischen Versorgung, und zwar in Form von diagnostischer und therapeutischer Unterstützung über räumliche Distanzen hinweg.4 Die wichtigsten Anwendungsgebiete der Telemedizin sind Telediagnostik, Telekooperation, Telekonsultationen, Teletherapie, Telemonitoring und Telekonferenzen (siehe Bild 1).
Telemedizin in Deutschland
Die Entwicklung in Deutschland ist durch strenge Gesetze und Verordnungen von medizinischen Berufsverbänden geprägt. Trotz zahlreicher Gesetzesinitiativen kommen die Selbstverwaltungsorgane des deutschen Gesundheitswesens beispielsweise bei der Implementierung der elektronischen Gesundheitskarte nur sehr langsam voran. Es überrascht daher auch nicht, dass Deutschland nur den vorletzten Platz in einer von der Bertelsmann Stiftung in Auftrag gegebenen internationalen Studie belegte. Bei dieser im Jahr 2018 in 17 Ländern durchgeführten Studie wurde der Stand der Digitalisierung im Gesundheitswesen nach folgenden Indikatoren analysiert und verglichen: „gesundheitspolitische Aktivitäten und Strategien”, „technische Implementierung und Bereitschaft zur Vernetzung und Datennutzung“ und „tatsächliche Nutzung von Daten“.7 Die Gründe für das schlechte Abschneiden des Gesundheitssystems in Deutschland liegen darin, dass es stark korporatistisch und föderalistisch geprägt ist.8 Es gibt zahlreiche telemedizinische Einzelprojekte, die von der deutschen Bundesregierung gefördert werden, aber im Gesundheitswesen nicht zum Einsatz kommen.
Teleophthalmologie und Auswirkungen der COVID-19-Pandemie
Im Bereich Ophthalmologie wird berichtet, dass die Nachfrage nach teleophthalmologischen Lösungen während der COVID-19-Pandemie drastisch gestiegen ist.9 Durch Telekonsultations-plattformen kann man das Risiko einer Infektion für Patienten aller ambulanten medizinischen Facheinrichtungen wie Augenarztpraxen und Augenkliniken minimieren, weil enger Kontakt in den Untersuchungsabteilungen, in Warte-bereichen oder auf dem Weg zu den Untersuchungsräumen eingeschränkt wird.
Künstliche Intelligenz (KI)
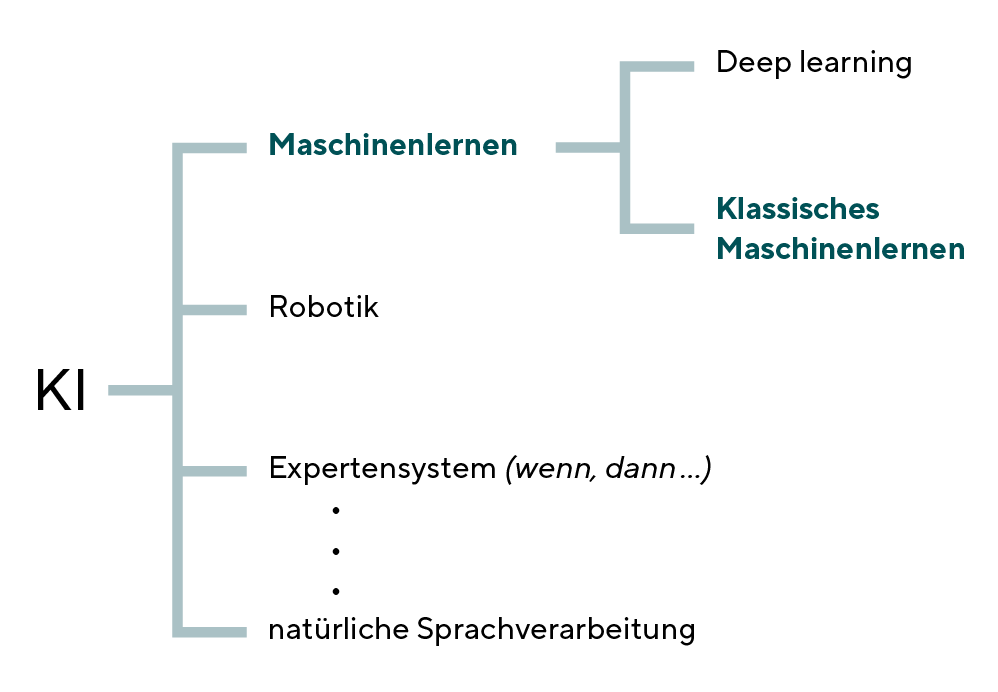
Künstliche Intelligenz bezeichnet die Fähigkeit einer Maschine, kognitive Aufgaben zu erfüllen, die mit dem menschlichen Gehirn assoziiert werden.10 KI hat viele Teilbereiche (Bild 2). Doch erst mit der enormen technischen Entwicklung von vier Faktoren – Big Data, Rechnerleistung, Speicherleistung und globale Vernetzung im Internet der Dinge – konnte der Bereich Deep Learning entstehen.11 Deep Learning ist eine Methode des statistischen Lernens, wobei sich die Bezeichnung „deep“ in diesem Kontext auf die Anzahl der Darstellungsschichten des neuronalen Netzes bezieht. Es geht hier folglich nicht um erwerbbares Wissen, sondern um eine Vielzahl von aufeinanderfolgenden Schichten. Mittlerweile können diese Netze Hunderte von Darstellungsschichten enthalten.12 Deep Learning basiert auf der Verwendung von künstlichen neuronalen Netzen, die mit vielen Schichten modelliert werden. Chollet betont, dass Deep-Learning-Modelle keine Nachbildungen des Gehirns sind, sondern mathematische Frameworks zur Mustererkennung anhand von Daten.12 Da sich faltende neuronale Netze (convolutional neural networks, CNN) bei Deep-Learning-Systemen als besonders erfolgreich in der Bilderkennung erwiesen haben, sind mit diesen Netzen enorme Fortschritte in jenen medizinischen Bereichen gemacht worden, die häufig mit bildgebenden Verfahren arbeiten; dazu zählen die Ophthalmologie, Dermatologie und Radiologie. Im Bereich der Ophthalmologie werden Deep-Learning-Systeme bei Fundusbildern, der optischen Kohärenztomografie und der Gesichtsfelduntersuchung eingesetzt. Hauptanwendungsgebiete sind die Untersuchung und Diagnose der wichtigsten Augenerkrankungen wie diabetischer Retinopathie, Glaukom und altersbedingter Makuladegeneration. Die Leistungsfähigkeit dieser Systeme ist in vielen Studien nachgewiesen worden.
Deep-Learning und die Untersuchung des Sehnervenkopfes bei Glaukom
Im Allgemeinen kann man Glaukomtests in zwei Gruppen einteilen: Tests zur Untersuchung von strukturellen glaukomatösen Veränderungen und Tests zur Untersuchung von funktionellen Veränderungen.13 Nach Ansicht von Tan et al. besteht die Herausforderung darin, dass beim Augenscreening diese Veränderungen zu einem bestimmten Zeitpunkt und nicht über einen längeren Zeitraum untersucht und beurteilt werden. Dennoch halten die Autoren die Verwendung der Fundusfotografie und optischen Kohärenztomografie (OCT) für ein vielversprechendes Verfahren zur Erkennung von glaukomatösen Strukturveränderungen. Digitale Fundusbilder in Farbe werden in den letzten Jahren häufig eingesetzt, um eine Glaukomdiagnose zu untermauern, weil die Fundusfotografie weit verbreitet und sehr viel kostengünstiger als die optische Kohärenztomografie ist.14 Die Fundusfotografie wird zur Untersuchung der Papille, der Nervenfaserschicht, des Cup-Disk-Verhältnisses sowie von Blutungen und Kerbenbildung am Rand der Papille verwendet; sie ermöglicht aber auch eine zuverlässige Befunddokumentation und einen sehr genauen Vergleich der Fotos bei nachfolgenden Untersuchungen. Es wurde bereits im Rahmen des GONE-Projekts (Glaucomatous Optic Neuropathy Evaluation Project) aufgezeigt, dass in der Glaukomdiagnostik die Genauigkeit subjektiver Auswertungen von monokularen Bildern des Sehnervenkopfes gleich hoch ist wie bei stereoskopischen Bildern.15 Li et al. evaluierten einen Deep-Learning-Algorithmus für die Erkennung von überweisungsrelevanter glaukomatöser Optikusneuropathie auf Basis von Fundusfotografien.16 Die Autoren wiesen nach, dass ein Deep-Learning-Algorithmus eine glaukomatöse Optikusneuropathie mit einer hohen Sensitivität und Spezifität von 95,6 % bzw. 92 % und mit einer Fläche von 0,986 unterhalb der ROC-Kurve (AUC-Wert) erkennen kann.16
In einer Studie von Gonzalez-Hernandez et al. wird die Deep-Learning-Technik zur automatischen Bestimmung der Position und Form des Sehnervenkopfes und zur Erkennung des Papillenrandes eingesetzt, um die Reproduzierbarkeit der Laguna ONhE-Methode zu optimieren.17Dieses Programm, das vom dänischen Softwarehersteller RetinaLyze System A/S (Ltd.) auf einer webbasierten Plattform betrieben und in Deutschland von einer SchweizerLizenzfirma als Screening-Tool im Rahmen ihrer Fundusbildanalyse angeboten wird, basiert auf folgendem Grundkonzept: Der Hämoglobingehalt des Sehnervenkopfes wird mithilfe der Farben auf dem Fundusbild festgestellt. Die Gewebedicke wird anhand der Farbunterschiede gemessen. Je dicker das Gewebe oder je höher dessen Hämoglobinkonzentration ist, desto intensiver sind die Farben; je dünner das Gewebe oder je geringer die Durchblutung ist, desto heller erscheinen die Farben.18 Die Blutgefäße des neuronalen Gewebes werden als Referenz für die Farbe verwendet. Werden die Farben des neuronalen Gewebes mit diesen Blutgefäßen verglichen, wird der Hämoglobingehalt in jedem Bereich des Gewebes berechnet, sodass eine repräsentative Karte der lokalen Hämoglobinverteilung aus verschiedenen Verhältnissen erstellt werden kann.13 Das vertikale Cup-Disk-Verhältnis wird aus den topografischen Verteilungen des Hämoglobins berechnet; eine sogenannte Glaukom-Diskriminanzfunktion (GDF) wird zur Berechnung des Glaukomrisikos verwendet. Probleme treten bei peripapillärer Atrophie und peripapillärer myopischer Atrophie auf, weil in diesen Fällen der Papillenrand manuell abgegrenzt werden muss. Ein weiterer Nachteil dieses Programms ergibt sich, wenn die retinalen Nervenfasern im Bereich der Lamina cribrosa sclerae myelinisiert sind.18 Trotz der exakten Analyse einzelner Parameter durch künstliche Intelligenz sind Akkara et al. der Meinung, dass eine umfassende KI alle Parameter auswerten sollte einschließlich Augeninnendruck, Papille, Kammerwinkel und Gesichtsfeld. Laut Autoren gibt es ein derartiges KI-System aber noch nicht.19 Diener weist zudem darauf hin, dass derzeit keine Untersuchungsmethode über genügend Daten verfügt, um ein Glaukom sicher diagnostizieren zu können.20
Deep Learning und altersbedingte Makuladegeneration (AMD) und diabetische Retinopathie (DR)
Als erstes Krankheitszeichen der altersbedingten Makuladegeneration treten gewöhnlich (asymptomatische) Makuladrusen auf, die häufig zufällig bei Fundusuntersuchungen oder auf Fundusbildern festgestellt werden.21 Drusen sind extrazelluläre Ablagerungen zwischen dem retinalem Pigmentepithel (RPE) und der Bruch-Membran (BM).22 Klinisch unterscheidet man harte und weiche Drusen; harte Drusen sind entweder weiß oder gelblich und haben einen scharf begrenzten Rand. Das Vorhandensein von kleinen Drusen ist an und für sich noch kein Hinweis auf eine AMD, weil sie beim Menschen zu den normalen Alterserscheinungen gehören. Drusen sind in ihrer Zusammensetzung selten homogen. Aufgrund ihrer gelben Farbe und Helligkeit auf Fundusfarbfotos sind Drusen mit dem menschlichen Auge erkennbar; Computeralgorithmen zur automatischen Erkennung von Anomalien müssen jedoch sehr robust gegenüber jenen Auffälligkeiten sein, die aufgrund ihrer Helligkeit den harten Drusen ähneln.22Burlina und Grassman haben auf Fundusbildern basierende DL-Algorithmen entwickelt, die mit dem Datensatz der ARED-Studie (Age Related Eye Disease Study) arbeiten. Der von Burlina et al. zur automatischen Erkennung und Auswertung von überweisungsrelevanter AMD entwickelte Algorithmus lieferte eine Treffgenauigkeit, die mit jener von Experten vergleichbar ist.23 Es wurde ein ähnliches DL-System entwickelt, das ebenfalls mit dem Datensatz der ARED-Studie arbeitet; zum Testen wurde dabei ein Datensatz mit 5555 Fundusfarbbildern verwendet, die im Rahmen der Kooperativen Gesundheitsforschung in der Region Augsburg (KORA-Studie) generiert wurden. Dieser Algorithmus zeichnet sich in den ARED-Daten ebenfalls durch eine hohe Klassifizierungsgenauigkeit aus, die jene von Untersuchern übertrifft.24 Ting et al. weisen im Zusammenhang mit dieser Studie jedoch darauf hin, dass der ARED-Datensatz hauptsächlich aus Daten von Personen über 55 Jahren besteht, weshalb viele dominante Makulareflexe im getesteten Fremddatensatz als neovaskuläre AMD fehlinterpretiert wurden. Dies unterstreicht, wie wichtig es ist, DL-Algorithmen mit verschiedenen klinischen Datensätzen und einem breiten Spektrum von Phänotypen und Patienten zu trainieren.25 Grassmann et al. vertreten in ihrer Studie ebenfalls die Ansicht, dass dieses Klassifizierungssystem in Augenkliniken oder -praxen nicht verwendet werden sollte.19
Im Gegensatz zur diabetischen Retinopathie, bei der sich die meisten Studien auf die Fundusfotografie konzentrieren, liegt das Hauptaugenmerk bei AMD auch auf der KI-gestützten optischen Kohärenztomografie.25,26 In Deutschland steht Optometristen die OCT derzeit allerdings nicht als Standardverfahren zur Verfügung. RetCAD V.1.3.0 (Thirona, Nijmegen, Niederlande) ist ein Beispiel für ein Deep-Learning-System zur automatischen Erkennung von AMD und DR, das CE-zertifiziert und im Handel erhältlich ist. Das System kann über eine in Deutschland angebotene telemedizinische Plattform genutzt werden. Der KI-Algorithmus, der auf der Technik eines sich faltenden neuronalen Netzes basiert, analysiert Farbfundusfotos auf das Vorhandensein von altersbedingter Makuladegeneration und diabetischer Retinopathie. Als Ausgabewerte gibt die Software einen Wert für die Bildqualität und einen Score-Wert für das Vorliegen von AMD und DR an. Der Score-Wert gibt an, wie hoch die Wahrscheinlichkeit einer Überweisung des Patienten an einen Augenarzt ist. Sogenannte Heatmaps zeigen die Lage der erkannten Bildanomalien an und dienen so als visuelle Hilfe bei der Untersuchung kritischer Bereiche auf der Netzhaut. Die Punktwerte reichen von 0 bis 100 und basieren auf dem ARED-Klassifizierungsprotokoll für AMD sowie auf der internationalen klinischen Schweregradeinteilung für DR (ICDR). Ein Punktwert zwischen 30 und 50 gilt als Schwellenwert für die Entscheidung zwischen Überweisung oder Nichtüberweisung. Mit niedrig gewählten Schwellenwerten wird eine hohe Sensitivität erzielt; dies hat jedoch den Nachteil, dass mehr falsch-positive Ergebnisse bei überweisungsrelevanten Befunden geliefert werden. Höhere Schwellenwerte führen zu einer hohen Gesamtspezifität auf Kosten von falsch-negativen Ergebnissen bei überweisungsrelevanten Daten. Gonzáles et al. kommen in ihrer Studie zu dem Schluss, dass dieses System bei der gleichzeitigen Erkennung von DR und AMD vergleichbare Leistungen wie Experten erbringt.27
Telemedizin und KI-Anwendungen für Optometristen in Deutschland
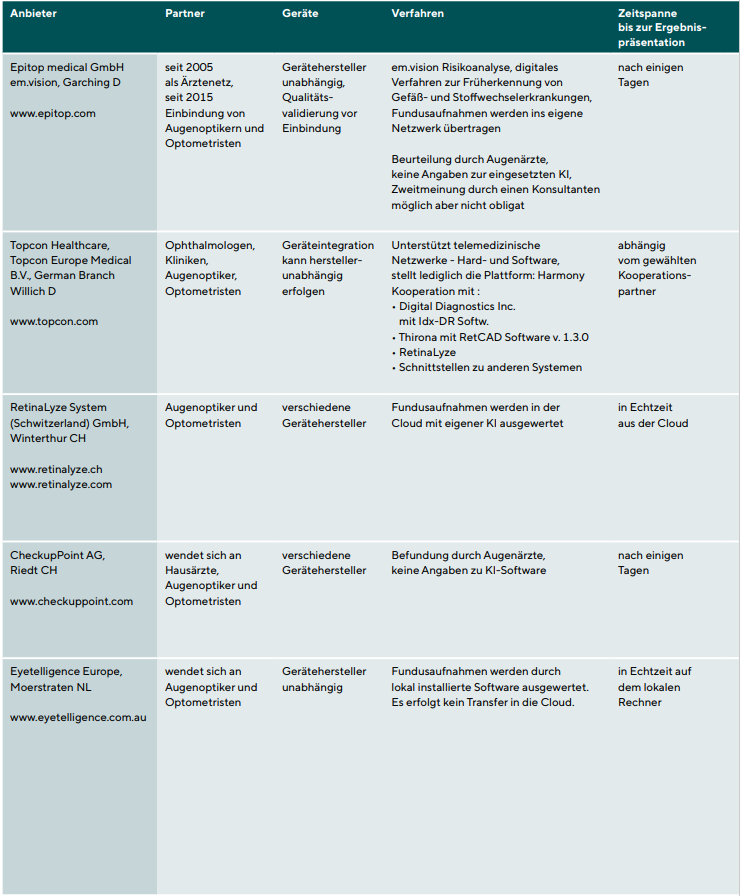
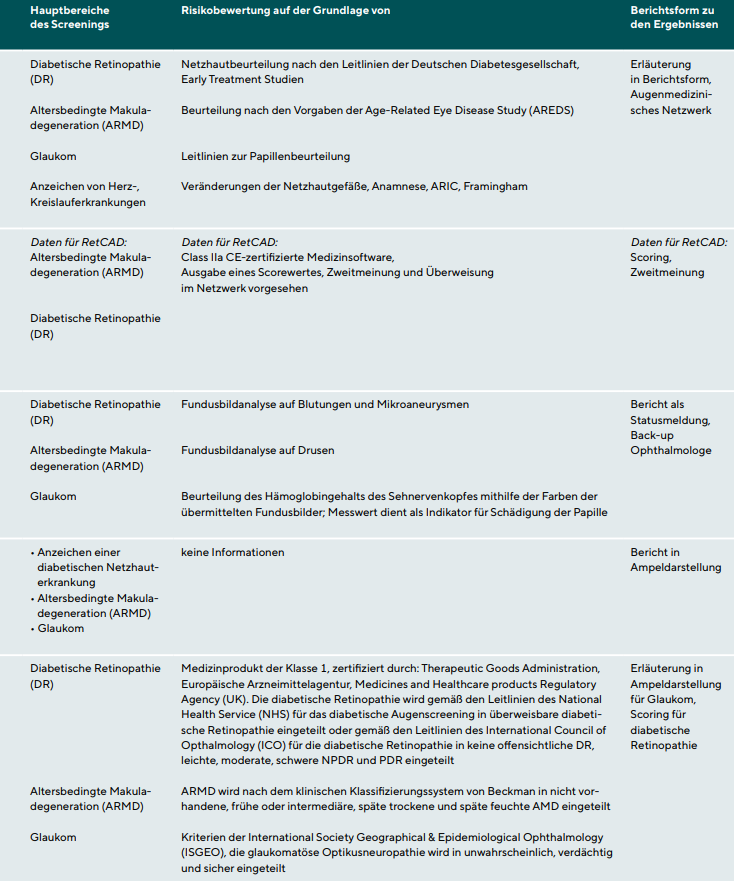
In Tabelle 1 sind die gegenwärtig auf dem deutschen Markt vertretenen Anbieter von telemedizinischen Dienstleistungen zusammengefasst; die Liste basiert auf der Auswertung deutschsprachiger Fachzeitschriften im Bereich Augenoptik und Optometrie aus dem Zeitraum 01/2018 - 06/2021 sowie auf der Analyse der Aussteller auf der Opti 2020 in München. Alle Anbieter von telemedizinischen Geräten verwenden künstliche Intelligenz. Allerdings arbeiten sie synchron entweder mit Augenärzten vor Ort oder mit ihren eigenen Ärzten im Hintergrund (Back-up-Ärzte) zusammen. Wenn ein KI-System eine Anomalie nicht kennt, kann die Bildauswertung durch diese Augenärzte erfolgen. Das bedeutet, dass die Ergebnisse, die Optometristen von den Netzwerken erhalten, von Fachärzten abgesichert werden. In Deutschland müssen Optometristen nämlich bei der Besprechung von Befundauffälligkeiten ihren Patienten erklären, dass sie die endgültige Diagnose nur von einem Augenarzt erhalten werden. Anbieter von telemedizinischen Dienstleistungen müssen Typ und Leistungsfähigkeit der von ihnen verwendeten KI nicht angeben.
Epitop Ltd
Eines der ersten telemedizinischen Programme in Deutschland wurde von der Firma Epitop in Garching entwickelt, die im Jahr 2015 ihr Netzwerk für Augenoptiker und Optometristen mithilfe eines medizinisches Netzwerks und einer selbst entwickelten Patientendatei ausgebaut hat. Die Bilder, die Augenoptiker und Optometristen mithilfe einer Funduskamera oder eines Laserscanners aufnehmen, werden digitalisiert, übermittelt und von dem an das Netzwerk angeschlossenen Augenarzt ausgewertet. Epitop macht keine Angaben zu Typ und Leistungsfähigkeit der verwendeten KI-Software. Eine Reihe von Geräteherstellern, die in das Netzwerk eingebunden sind, halten die technischen Hürden so niedrig wie möglich. In der Regel besprechen Optometristen die Auswertung mit ihren Patienten, wenn der Befund nach einigen Tagen telemedizinisch übermittelt worden ist. Der Befund enthält auch Empfehlungen für eventuelle weitere Maßnahmen. Der Vorteil dieses Systems liegt darin, dass Optometristen in das Netzwerk der Augenärzte integriert sind, das sich nach Möglichkeit an der geografischen Lage der Netzwerkpartner orientiert. Dieses System ist in erster Linie konzipiert für die Befundung von telemedizinischen Bilddaten zur Erkennung von diabetischer Retinopathie, altersbedingter Makuladegeneration und Glaukom, aber auch von Veränderungen der Netzhautgefäße, die auf kardiovaskuläre Erkrankungen hinweisen können. Durch die Einbindung von Optometristen in das Netzwerk steht Kunden bei Bedarf und auf Wunsch eine regionale Vernetzung zur Verfügung.
Topcon Deutschland Medical GmbH
Eine Lösung für die digitale Vernetzung von Augenärzten und Optometristen, die auf einer herstellerunabhängigen Software basiert und zugleich auch die Integration von künstlicher Intelligenz unterstützt, ist von der Firma Topcon Deutschland Medical GmbH realisiert worden. Mithilfe der unter dem Namen Harmony vermarkteten Plattform für telemedizinische Dienstleistungen können unterschiedlichste medizinische Geräte in einer Augenarzt- oder Optometristenpraxis lokal oder an verschiedenen Standorten miteinander verbunden werden. Die cloudbasierte Software ermöglicht auch den Einsatz von künstlicher Intelligenz und bietet Schnittstellen zu den KI-Anbietern.Durch die Zusammenarbeit mit IDx Technologies Inc., einem privaten KI-Diagnostikunternehmen in den USA, ist es möglich, dessen IDx-DR-System zur Erkennung von diabetischer Retinopathie anhand von Fundusbildern zu verwenden. IDx-DR ist das erste auf KI basierende Diagnosesystem mit einer FDA-Zulassung in den USA und einer CE-Kennzeichnung in Europa als Medizinprodukt der Klasse IIa zur autonomen Erkennung von diabetischer Retinopathie. Die RetCAD KI-Software kann auch in das System integriert werden. In Deutschland gibt es bereits ein erfolgreich umgesetztes Gesundheitsnetzwerk zwischen Augenarztpraxen und einem Optometristen. Die Mess- und Prüfgeräte eines von einem Optometristen geführten Augenzentrums sind über eine digitale Plattform mit den ophthalmologischen Messgeräten von zwei Augenarztpraxen sowie weiteren augenoptischen Praxen verbunden. Die lokale Vernetzung entlastet die Augenärzte im Bereich der Vorsorgeuntersuchungen und Screenings und bietet den Kunden im Bedarfsfall einen schnellen Zugang zu fachärztlicher Versorgung.
Retinalyze System A/S
Die Schweizer Firma RetinaLyze ist Lizenzpartner von Retinalyze System A/S, einem dänischen Unternehmen mit Sitz in Hellerup, das sich auf die Auswertung von Fundusbildern mithilfe von künstlicher Intelligenz konzentriert. Der Optometrist erstellt Fundusbilder, die an ein webbasiertes Portal übertragen werden, und erhält in Echtzeit eine Rückmeldung als Statusbericht, den er sofort mit dem Patienten besprechen kann. Wenn die Ergebnisse des KI-Systems nicht eindeutig sind, wird der Back-up-Augenarzt hinzugezogen, der sich mit dem Optometristen in Verbindung setzt; in Zweifelsfällen bedeutet das eine zusätzliche Sicherheit bei der Befundung. In Deutschland arbeiten zwei Augenärzte für alle Systempartner; eine regionale oder lokale Vernetzung ist in diesem System nicht integriert. Wenn ein Patient zum Augenarzt überwiesen werden muss und der Optometrist keinen Zugang zu seinem eigenen Netz von Augenärzten und Kliniken hat, muss der Patient den Termin mit dem Augenarzt vor Ort selbst vereinbaren. Die Retinalyze KI-Software wird hauptsächlich zur Überprüfung von Fundusbildern auf eventuelle Auffälligkeiten verwendet, die auf diabetische Retinopathie, altersbedingte Makuladegeneration oder Glaukom hinweisen.
Checkuppoint AG
Dieses Unternehmen mit Sitz in der Schweiz bietet ebenfalls telemedizinische Dienstleistungen an. Laut Firmendokumentation erfolgt die Befundung durch Augenärzte; die Auswertung in Form eines Berichts nach dem Ampelprinzip wird dem Optometristen übermittelt. Das Hauptaugenmerk liegt bei diesem System auf der Erkennung von klinischen Anzeichen für diabetische Netzhauterkrankungen oder AMD. Ein eventueller Nachteil dieses Systems besteht darin, dass Optometristen auf ihr eigenes Referenznetzwerk von Augenärzten oder Kliniken angewiesen sind. Es liegen keine Informationen zu Typ und Leistungsfähigkeit der verwendeten KI-Software vor.
Eyetelligence
Seit Mitte 2021 wird die Eyetelligence Assure Software für den Arbeitsplatz vom australischen Unternehmen Eyetelligence in Deutschland angeboten. Diese Software ist von verschiedenen zuständigen Behörden (Tabelle 1) als Medizinprodukt der Klasse I für den klinischen Einsatz zugelassen. Der Hersteller, dessen Software auf dem lokalen Rechner des Augenarztes oder Optometristen installiert wird und dadurch keine Daten in der Cloud speichert, benötigt Fundusbilder für die Befundung. Die Software unterstützt die meisten gängigen Kameramodelle der wichtigsten Hersteller (DRS, Nidek, Topcon, Zeiss). Die Fundusbilder werden auf Merkmale von Glaukom, DR und AMD analysiert. Zur Glaukomerkennung wird ein Ampelsystem zur Einstufung des Risikogrades verwendet; der Schweregrad von DR wird auf einer Bewertungsskala beurteilt. Weitere Informationen wie die Genauigkeit des Screening-Programms für einzelne Augenerkrankungen und die Unterstützung der Benutzer bei nicht erkannten Auffälligkeiten liegen zum Zeitpunkt der Verfassung dieses Artikels (Juli 2021) nicht vor.
Ergebnisse der Expertenbefragungen
Die Interviews mit den Experten wurden im Juni und Juli 2020 telefonisch durchgeführt. Für den Interviewleitfaden wurden folgende vier Hauptthemen gewählt: (1) Einsatz von telemedizinischer Unterstützung und künstlicher Intelligenz; (2) Vor- und Nachteile einer telemedizinischen Unterstützung für die am optometrischen Screening Beteiligten; (3) Umsetzung von telemedizinischen Modellen in Unternehmen; (4) Vertiefung und Ausbau der Kompetenzen von Optometristen.
Im Folgenden wird schwerpunktmäßig auf die wichtigsten Empfehlungen von Experten, auf spezifische Erfahrungen aus Anfangsschwierigkeiten bei der Umsetzung in die Praxis und auf Weiter- und Ausbildungsmöglichkeiten eingegangen. Für Unternehmen, die den Einstieg in ein telemedizinisches Netzwerk (TN) planen, ergeben sich, laut befragten Experten, sowohl Herausforderungen als auch offensichtliche Chancen. Bei der Umsetzung sehen die Befragten die Herausforderungen in der Notwendigkeit eines klar definierten Maßnahmenkatalogs, dessen schrittweise Implementierung auf die Zukunftsstrategie des Unternehmens abgestimmt werden muss. Für den Umsetzungsprozess empfehlen die Experten, Ziele und Meilensteine zu Beginn der Implementierung klar zu definieren. Als Grundlage dienen eine Analyse der Unternehmensorganisation und der vorhandenen Unternehmensressourcen wie räumliche Aus-stattung, Personal und Finanzen sowie die Entwicklung und der Ausbau der technischen Expertise im Unternehmen. Diese professionelle Expertise umfasst unter anderem optometrisches Fachwissen sowie Kommunikationsfähigkeiten im Kontakt mit Patienten und Augenärzten. Und schließlich müssen sich Optometristen einen Überblick über die verwendeten technischen Geräte und deren Vor- bzw. Nachteile verschaffen. Eventuell ist auch auf vorhandene Schnittstellen zu den verschiedenen Netzwerkanbietern zu achten; gewisse Geräte können oft besonders nutzerfreundlich eingebunden werden, während bei anderen beispielsweise zur Übertragung der Bilddokumentation die Bilder separat ins Netzwerk hochgeladen werden müssen. Dadurch wird der Arbeitsablauf im Unternehmen möglicherweise erheblich behindert. Insgesamt sind die befragten Experten der Meinung, dass der richtige Ansatz bei der Umsetzung von KI eine wesentliche Voraussetzung für deren Erfolg und Zukunftsfähigkeit ist. Sie halten künstliche Intelligenz im allgemeinen für sehr relevant, was durch die Tatsache untermauert wird, dass in Deutschland alle Unternehmen, die telemedizinische Dienstleistungen für Optometristen anbieten, bereits KI einsetzen.
Optometristen in Deutschland, die ein telemedizinisches Netzwerk nutzen, werden zusätzlich noch fachlich abgesichert: Aufgrund der Rechtslage ist bei diesen Netzwerken im allgemeinen entweder die Auswertung durch einen Augenarzt vorgesehen oder im Fall einer nicht eindeutigen Befundung durch die KI ein sogenannter Back-up-Augenarzt eingebunden. Diese Konzeptionsform der telemedizinischen Netzwerke bietet eine großartige Möglichkeit, Optometristen besser in die Präventivversorgung einzubeziehen. Dies ist vor allem der Fall, wenn durch die telemedizinische Vernetzung eine lokale Vernetzung von Augenärzten und Optometristen ermöglicht wird und wenn diese Vernetzung nicht auf Konkurrenz, sondern auf der Erkenntnis beruht, dass beide Netzwerkbeteiligten für die Prävention von Augenkrankheiten und das Wohl der Patienten und Klienten zusammenarbeiten. Laut einem Interviewpartner (CEO einer TN) haben die vernetzten Augenärzte realisiert, dass die Befundung einer Anomalie nur zehn Prozent der Patientenanamnese ausmacht, die Behandlung einer Anomalie dann aber immer durch die Augenärzte erfolgen muss.
Ein besonderes Augenmerk müssen Unternehmen auf das interne und externe Marketing legen. Die Marketingkommunikation beginnt innerhalb der eigenen Firma bei den Mitarbeitern. Es können Workshops und Schulungen für Mitarbeiter angeboten werden, damit diese lernen, die Möglichkeiten und Vorteile von KI den Patienten gegenüber klar zu kommunizieren. Zudem muss auch eine eindeutige Abgrenzung der eigenen Kompetenzbereiche erfolgen, was die Auswertung der beobachteten Auffälligkeiten und deren Einstufung (auffällig oder unauffällig) angeht. Die Patienten wiederum haben noch kein umfassendes Wissen über das Tätigkeitsfeld von Optometristen und -- speziell im Bereich künstlicher Intelligenz -- auch kein volles Vertrauen in diesen Anwendungsbereich. Bedenken hinsichtlich der Datensicherheit dürfen auch nicht außer Acht gelassen werden, weil die telemedizinische Verarbeitung von Gesundheits-daten besondere Sorgfalt und technische Sicherheitsmaßnahmen erfordert. Gesundheitsdaten dürfen nur mit Zustimmung der betroffenen Person kommuniziert oder übertragen werden; zudem sind sie durch die Datenschutzverordnung der Europäischen Union (DSGVO) ausdrücklich geschützt. Die befragten Experten empfehlen Optometristen dringend eine Koordination mit den kooperierenden Augenärzten vor Ort. Dadurch kann ein Standard für die Beschreibung und Dokumentation von Auffälligkeiten definiert und die zukünftige Kommunikation mit den Augenärzten erleichtert werden.
Zweifelsohne wird die praktische Durchführung von Augenscreenings durch Optometristen als wichtigster Faktor bei der Vertiefung der Fachkenntnisse von Optometristen angesehen. Optometristen sollten die Teilnahme an einem Netzwerk als grundlegende Möglichkeit sehen, anhand der Befundberichte, die sie mit jedem übermittelten Fall erhalten, ihr Fachwissen überprüfen und weiter ausbauen zu können. Es wurde Kritik geäußert, dass viele angebotenen Schulungsmaßnahmen nicht so gut angenommen werden, wie dies von den Anbietern erwartet wird. Als Gründe dafür werden Ressourcenknappheit sowie zeitlicher und finanzieller Aufwand angeführt. Aufgrund der Covid-19-Pandemie vollziehen einige Unternehmen bereits einen Wandel hin zu umfassenderen Online-Angeboten und frei zugänglichen Podcasts.
Schlussfolgerung
Optometristen in Deutschland wird empfohlen, sich grundlegend mit den Möglichkeiten auseinanderzusetzen, die telemedizinische Netzwerke und die Einbindung von künstlicher Intelligenz bieten. Aus Schulungen und Ausbildungen im Zusammenhang mit diesen Netzwerken ergeben sich großartige Möglichkeiten zur beruflichen Weiterentwicklung. Es gibt viele Vorteile für Patienten, Optometristen und Augenärzte. Bevor Optometristen in eines dieser Netzwerke einsteigen, sollten sie sich jedoch einen Plan, ein Konzept und eine Strategie zurechtgelegt haben.
Interessenkonflikt
Der Autor hat keinen Interessenkonflikt in Bezug auf die im Artikel genannten Methoden und Geräte.
Danksagung
Mein herzlicher Dank geht an Prof. Dr. Anna Nagl von der Hochschule Aalen, Deutschland und Prof. Dr. Tony Cavallerano vom New England College of Optometry in Boston, USA für ihre hilfreichen Anregungen und konstruktiven Vorschläge. Ein besonderer Dank gilt allen, die bereitwillig an meinen Interviews teilnahmen.
659-667.
